科研教學
藥物(wù)/醫(yī)療器(qì)械臨床試驗立項指引
發布日期:2021-09-26 09:47
作者:
點擊:3386
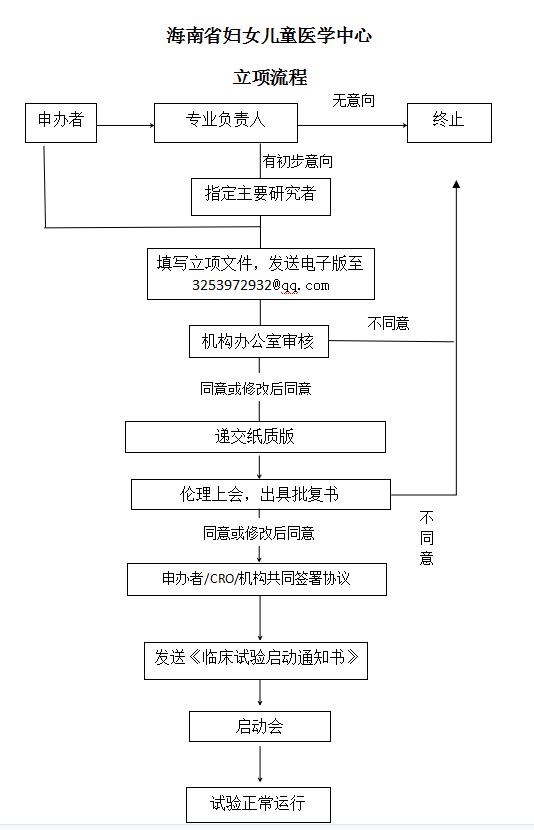
注意事(shì)項:
1、項目立項所需材料?
答:電(diàn)子版及紙(zhǐ)質版均需要,紙(zhǐ)質版遞交至機(jī)構辦公室(龍昆南(nán)路(lù)75号省婦幼9樓),電(diàn)子版發送至機(jī)構辦郵箱:3253972932@qq.com,需等電(diàn)子版審核無誤在提交紙(zhǐ)質版。
2.PI已簽字的《臨床試驗(藥物(wù)/器(qì)械)立項申請表》3份。
3.應出具GMP證書;若無,出具無GMP說明。
4.如藥品委托其它非申辦方的廠家生(shēng)産,需出具委托書。
5.研究方案需完善PI簽字。
6.所有申辦方提供資料需加蓋申辦方公章。
7.知情同意書需寫具體簽署時間,幾點幾分,需寫中心醫(yī)學倫理委員(yuán)會(huì)電(diàn)話。
8.團隊成員(yuán)情況表質控人員(yuán)隻能(néng)授權質控,不能(néng)授權其它分工(gōng)。